Capire l'avvelenamento da catalizzatore nei catalizzatori di metalli preziosi: Cause, problemi e soluzioni
1 Introduzione
I catalizzatoridi metalli preziosi svolgono un ruolo importante nell'industria chimica, nel settore energetico e nella protezione dell'ambiente. Grazie alla loro struttura elettronica unica e alle loro proprietà superficiali, i catalizzatori di metalli preziosi possono catalizzare efficacemente diverse reazioni chimiche. Tuttavia, nella pratica, le sostanze tossiche spesso influiscono su questi catalizzatori, causando una diminuzione dell'attività, un'alterazione della selettività e persino una riduzione della durata di vita. Per affrontare questa sfida, questo blog discuterà in dettaglio i meccanismi e le applicazioni dei catalizzatori di metalli preziosi, esaminerà le cause e gli effetti dell'avvelenamento dei catalizzatori e proporrà misure per migliorare le loro capacità anti-avvelenamento e la loro durata.

Fig. 1 Polvere di platino nero (grado per celle a combustibile) fornita da Stanford Advanced Materials
2 Introduzione ai catalizzatori di metalli preziosi
2.1 Meccanismi dei catalizzatori di metalli preziosi
In termini di struttura elettronica, i metalli nobili (ad esempio, platino, palladio, rodio, iridio, ecc.) hanno orbitali di elettroni d pieni o quasi pieni. Questi orbitali di elettroni d possono effettivamente sovrapporsi agli orbitali delle molecole reagenti, fornendo così l'energia di attivazione necessaria affinché la reazione possa avvenire con una barriera energetica più bassa. La partecipazione di elettroni d consente ai metalli preziosi di formare intermedi con un'ampia gamma di reagenti (ad esempio, idrogeno, ossigeno, idrocarburi, ecc.) e di facilitare il processo di reazione. L'elevata densità di elettroni e l'uniformità di distribuzione degli atomi di metalli preziosi conferiscono un'alta densità di nubi di elettroni sulle loro superfici. Ciò aiuta il catalizzatore di metallo nobile a fornire o accettare elettroni nella reazione, svolgendo il ruolo di buon donatore o accettore di elettroni e promuovendo la reazione.
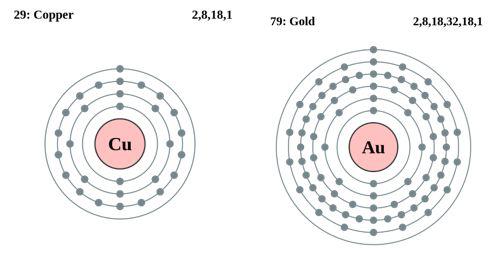
Fig. 2 Disposizione periferica degli elettroni degli atomi di rame e oro
Dal punto di vista delle proprietà superficiali, la superficie del metallo prezioso ha una forte capacità di adsorbimento, in grado di assorbire efficacemente le molecole reagenti. Questa capacità di adsorbimento deriva principalmente dalla forte interazione tra gli atomi di metallo prezioso e dall'elevata attività degli atomi di superficie. I catalizzatori di metalli preziosi possono interagire con le molecole reagenti attraverso l'adsorbimento sia fisico che chimico, fornendo siti attivi per promuovere la reazione. Le superfici dei catalizzatori di metalli preziosi hanno anche una buona capacità di ricostruzione. Durante il processo di reazione, la superficie degli atomi di metallo prezioso può subire un certo grado di ricostruzione per adattarsi all'adsorbimento e alla reazione di diverse molecole reagenti. Questa capacità di rimodellamento della superficie aiuta il catalizzatore a mantenere un'efficiente attività catalitica in diverse condizioni di reazione.
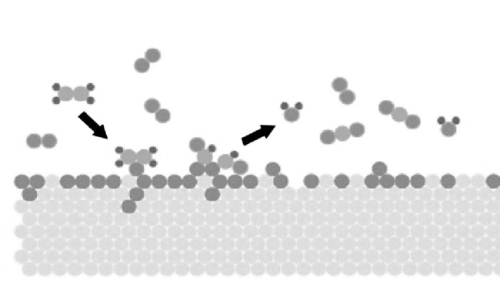
Fig. 3 Schema della reazione di molecole di gas adsorbite sulla superficie dei metalli preziosi
Inoltre, i metalli preziosi hanno un'elevata stabilità termodinamica e possono mantenere la loro struttura e attività catalitica a temperature elevate e in ambienti chimici difficili. Ciò consente ai catalizzatori di metalli preziosi di mostrare un'eccellente durata e stabilità in un'ampia gamma di reazioni industriali (ad esempio, cracking ad alta temperatura, reazioni di ossidazione, ecc.)
I catalizzatori di metalli preziosi sono in grado di catalizzare molti tipi di reazioni, tra cui idrogenazione, ossidazione, disproporzionamento, accoppiamento e così via. Questa versatilità è dovuta principalmente all'abbondanza di siti attivi in superficie e alla flessibilità delle strutture elettroniche, che consentono ai metalli preziosi di adattarsi a diversi meccanismi e condizioni di reazione. Diversi tipi di metalli preziosi possono anche formare leghe con altri metalli per regolare ulteriormente le loro strutture elettroniche e proprietà superficiali. Ad esempio, i catalizzatori in lega di platino-palladio mostrano prestazioni catalitiche superiori a quelle dei singoli metalli in alcune reazioni. Le leghe possono ottimizzare l'attività, la selettività e la stabilità dei catalizzatori di metalli preziosi, migliorando così le loro prestazioni complessive.
2.2 Applicazioni dei catalizzatori di metalli preziosi
I catalizzatori di metalli preziosi sono utilizzati nel trattamento dei gas per proteggere l'ambiente grazie al loro effetto catalitico sulle reazioni dei gas. I catalizzatori ternari comunemente utilizzati nel trattamento dei gas di scarico delle automobili utilizzano platino (Pt), palladio (Pd) e rodio (Rh) come componenti principali per convertire il monossido di carbonio (CO), gli ossidi di azoto (NOx) e gli idrocarburi incombusti (HC) presenti nei gas di scarico delle automobili in anidride carbonica (CO2), azoto (N2) e acqua (H2O) innocui. Il platino e il palladio sono utilizzati anche nei sistemi di trattamento dei gas di scarico diesel per ossidare il particolato carbonioso e gli ossidi di azoto emessi dai motori diesel. Anche il trattamento dei gas di scarico negli impianti chimici industriali e nelle raffinerie utilizza catalizzatori di metalli preziosi come il platino e il palladio, in grado di rimuovere efficacemente i componenti nocivi dai gas di scarico. I sensori chimici basati su catalizzatori di metalli preziosi sono utilizzati per rilevare inquinanti gassosi, gas tossici e biomolecole nell'ambiente, ad esempio sensori di idrogeno e sensori di formaldeide. I catalizzatori di metalli preziosi sono utilizzati anche per la degradazione degli inquinanti, come la degradazione fotocatalitica degli inquinanti organici nel trattamento delle acque e i catalizzatori composti di platino e ossidi di titanio nell'idrolisi fotocatalitica dell'acqua per la produzione di idrogeno.
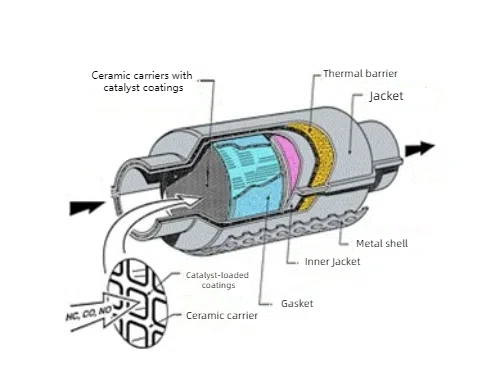
Fig. 4 Struttura del convertitore catalitico a tre vie
Nel campo dell'energia, i catalizzatori di metalli preziosi, in particolare quelli di platino, sono utilizzati nel processo elettrochimico di elettrolisi dell'acqua e di ossidazione delle celle a combustibile a metanolo per migliorare l'efficienza della conversione dell'energia elettrica. I catalizzatori di platino nelle celle a combustibile a membrana a scambio protonico (PEMFC) promuovono la reazione elettrochimica tra idrogeno e ossigeno agli elettrodi per generare elettricità e acqua. I catalizzatori in lega di platino-rutenio nelle celle a combustibile a metanolo diretto (DMFC) sono utilizzati per ossidare il metanolo e migliorare l'efficienza della cella a combustibile. Gli elettrodi di platino possono essere utilizzati anche per elettrolizzare l'acqua per produrre idrogeno, migliorando l'efficienza della reazione. I catalizzatori di metalli preziosi sono utilizzati anche nella conversione delle biomasse per trasformarle in prodotti chimici e carburanti ad alto valore aggiunto, come la reazione di idrodeossigenazione nella produzione di biodiesel.
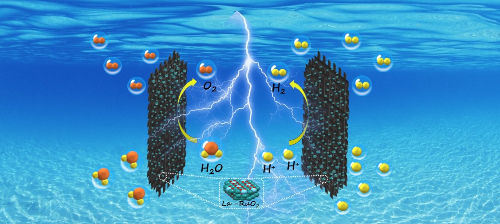
Fig. 5 Produzione di idrogeno da acqua elettrolitica acida catalizzata da La-RuO2 [5]
Nella produzione chimica, i catalizzatori a base di metalli preziosi sono ampiamente utilizzati in applicazioni di tipo organico. Nell'industria della raffinazione del petrolio, i catalizzatori di platino e palladio possono essere utilizzati nel processo di idrodesolforazione per rimuovere i solfuri dal petrolio greggio, migliorando così la qualità del carburante. Nel processo di reforming del petrolio, i catalizzatori di platino contribuiscono anche alla produzione di benzina ad alto numero di ottani e di composti aromatici. Nell'industria della sintesi organica, i catalizzatori di platino e palladio sono ampiamente utilizzati per catalizzare le reazioni di idrogenazione, migliorando significativamente l'efficienza del processo di idrogenazione dei doppi e tripli legami di vari composti organici. I catalizzatori di palladio possono anche catalizzare la reazione di accoppiamento Suzuki e la reazione Heck, che svolgono un ruolo importante nella sintesi di farmaci e nella costruzione di molecole organiche complesse. Nel campo della sintesi dei farmaci, i catalizzatori di metalli preziosi sono spesso utilizzati per le trasformazioni chimiche nei passaggi chiave, come le reazioni di cross-coupling catalizzate dal palladio, che svolgono un ruolo insostituibile nella sintesi di molecole di farmaci complessi. I catalizzatori di platino e palladio sono anche comunemente utilizzati nella catalisi chirale, catalizzando processi di reazione di idrogenazione asimmetrica per produrre intermedi di farmaci chirali, garantendo la purezza ottica e l'attività biologica dei farmaci. I catalizzatori di metalli preziosi hanno importanti applicazioni nella preparazione di nanomateriali, come l'uso di catalizzatori di platino e oro per preparare nanomateriali ad alte prestazioni da utilizzare in dispositivi elettronici e optoelettronici.
3 Avvelenamento da catalizzatore
3.1 Definizione di avvelenamento da catalizzatore
L'avvelenamento dei catalizzatori si riferisce alla perdita o alla riduzione significativa dell'attività catalitica di un catalizzatore durante una reazione chimica a causa della presenza di alcune sostanze (note come veleni o sostanze velenose). Questi veleni chemisorbono fortemente o reagiscono con i siti attivi del catalizzatore, impedendo così al catalizzatore di entrare in contatto e reagire normalmente con i reagenti. L'avvelenamento del catalizzatore è un fenomeno sfavorevole che porta a una riduzione dell'efficienza della reazione chimica o addirittura al suo completo arresto.
3.2 Cause e tipi di avvelenamento del catalizzatore
Esistono tre meccanismi principali di avvelenamento del catalizzatore.
1. Assorbimento chimico: Forte adsorbimento chimico di molecole velenose con i siti attivi del catalizzatore, in modo che questi siti non possano continuare a reagire con i reagenti.
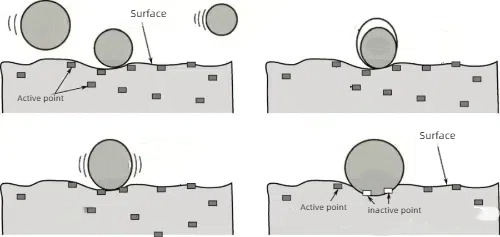
Fig. 6 Principio schematico del Chemisorbimento
2. Reazione chimica: Il tossico reagisce con i componenti attivi del catalizzatore per produrre composti inattivi che ricoprono la superficie del catalizzatore.
3. Blocco fisico: Alcuni veleni formano depositi sulla superficie del catalizzatore, bloccando fisicamente i pori o i siti attivi del catalizzatore.
La disattivazione causata dall'avvelenamento del catalizzatore è diversa per cause e gradi differenti.
1. Avvelenamento temporaneo (avvelenamento reversibile): Quando il veleno è adsorbito o combinato chimicamente sul centro attivo, la forza di legame generata è relativamente debole e si possono adottare metodi appropriati per rimuovere il veleno, in modo da ripristinare l'attività del catalizzatore senza alterarne la natura; questo tipo di avvelenamento è chiamato avvelenamento reversibile o avvelenamento temporaneo.
2. Avvelenamento permanente (avvelenamento irreversibile): Il veleno interagisce con i componenti attivi del catalizzatore formando un legame chimico molto forte ed è difficile rimuovere il veleno in modo generale per ripristinare l'attività del catalizzatore; questo tipo di avvelenamento è chiamato avvelenamento irreversibile o avvelenamento permanente.
3. Avvelenamento selettivo: dopo l'avvelenamento, il catalizzatore può perdere la capacità catalitica per una certa reazione, ma avere ancora attività catalitica per altre reazioni; questo fenomeno è chiamato avvelenamento selettivo. In una serie di reazioni, se il veleno provoca solo l'avvelenamento del sito attivo della reazione successiva, la reazione può rimanere nella fase intermedia e ottenere un'elevata resa di prodotti intermedi.
4 Problemi causati dall'avvelenamento del catalizzatore
4.1 Riduzione dell'attività del catalizzatore
1. Occupazione dei siti attivi: Le tossine si chimificano fortemente o reagiscono con i siti attivi sulla superficie del catalizzatore, causando l'occupazione di questi siti da parte della tossina e impedendo l'adsorbimento e la reazione delle molecole di reagente, con conseguente riduzione significativa dell'attività del catalizzatore. Ad esempio, i solfuri (ad esempio, H2S) reagiscono con la superficie dei catalizzatori di platino o palladio formando solfuro di platino o solfuro di palladio, rendendo così inutili i siti attivi.
2. Copertura superficiale: le tossine formano uno strato di copertura sulla superficie del catalizzatore che impedisce fisicamente ai reagenti di raggiungere i siti attivi del catalizzatore. Questo effetto di copertura riduce anche notevolmente l'area superficiale effettiva del catalizzatore e ne diminuisce l'attività. Ad esempio, i fosfati formano uno strato di copertura sulla superficie di alcuni catalizzatori che impedisce l'adsorbimento dei reagenti.
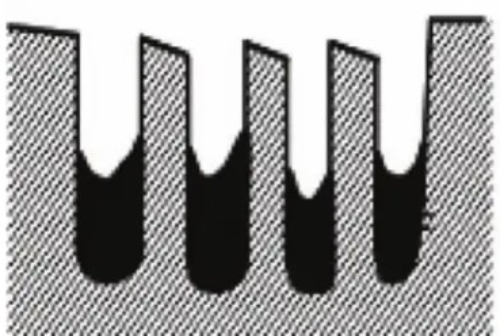
Fig. 7 Struttura del catalizzatore passivato dopo la copertura superficiale
4.2 Cambiamenti selettivi
1. Occupazione specifica dei siti attivi
Alcuni tossici si legano selettivamente a specifici siti attivi, modificandone l'attività e la funzione. Ad esempio, alcune reazioni possono dipendere da specifici tipi di siti attivi (ad esempio, siti situati su determinati piani cristallini o in specifiche disposizioni atomiche) e l'adsorbimento di tossici occuperà preferenzialmente questi siti, alterando così la selettività complessiva del catalizzatore.
Ad esempio, nell'idrogenazione selettiva dell'etilene, i catalizzatori di Pd presentano un'elevata selettività, ma se la superficie del catalizzatore è avvelenata dallo zolfo (S), gli atomi di zolfo si adsorbiranno preferenzialmente ai siti attivi della superficie del Pd, alterando le proprietà superficiali del catalizzatore e dando luogo a una reazione più incline a produrre etano indesiderato anziché etilene.
2. Alterazione del percorso di reazione
La presenza di un tossico può alterare il percorso di una reazione catalizzata, anche se non occupa completamente il sito attivo, modificando le proprietà elettroniche o geometriche della superficie del catalizzatore, rendendo più difficile la formazione di alcuni intermedi o stati di transizione o più probabile la decomposizione, con conseguente orientamento della reazione verso un prodotto diverso.
Un esempio tipico è la variazione della densità di elettroni sulla superficie di un catalizzatore di rodio (Rh) dopo l'avvelenamento del catalizzatore da parte del fosforo (P) nella reazione di idroformilazione del propilene, con conseguente spostamento del prodotto principale generato dalla n-butirraldeide all'isobutirraldeide, un cambiamento di selettività dovuto al diverso effetto stabilizzante del fosforo sugli intermedi di reazione.
3. Rimodellamento della superficie e cambiamenti geometrici
L'adsorbimento di sostanze tossiche sulla superficie del catalizzatore può causare il riarrangiamento o il rimodellamento di atomi o molecole sulla superficie del catalizzatore, modificandone la geometria e influenzando così l'adsorbimento e i percorsi di reazione delle molecole reagenti. Tali cambiamenti geometrici possono portare a una diminuzione o a una completa perdita di selettività per alcune reazioni specifiche.
Nella reazione di sintesi di Fischer-Tropsch, i catalizzatori a base di ferro (Fe) sono utilizzati per la sintesi di idrocarburi a catena lunga. Tuttavia, quando la superficie del catalizzatore di Fe viene avvelenata dallo zolfo, gli atomi di zolfo causano un rimodellamento della superficie che diminuisce la generazione di idrocarburi a catena lunga e aumenta la generazione di metano e idrocarburi a catena corta. Questo cambiamento di selettività è dovuto alla modifica della struttura geometrica dei siti attivi sulla superficie.
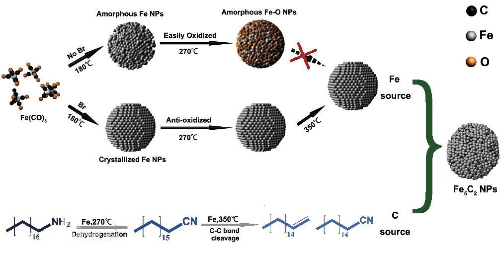
Fig. 8 Principio schematico del processo Fischer-Tropsch
4. Cambiamenti di stabilità degli intermedi
La presenza di sostanze tossiche può alterare la stabilità degli intermedi di reazione sulla superficie del catalizzatore, determinando un più facile desorbimento o una più difficile generazione di alcuni intermedi, limitando così la distribuzione del prodotto finale della reazione.
Nella reazione di ossidazione del propilene, il catalizzatore di molibdeno (Mo) viene utilizzato per generare acroleina, ma se il catalizzatore viene avvelenato dal cloro (Cl), il cloro altera la stabilità degli intermedi di reazione (ad esempio, l'ossido di propilene), con conseguente diminuzione della selettività della generazione di acroleina e aumento della generazione di prodotti di ossidazione incompleti come l'anidride carbonica.
5. Effetto elettronico
L'adsorbimento di sostanze tossiche modifica l'ambiente elettronico sulla superficie del catalizzatore, influenzando l'energia di adsorbimento e le barriere energetiche di reazione dei reagenti. Soprattutto quando il tossico è fortemente elettronegativo o può formare una differenza di densità elettronica con la superficie del metallo, questo effetto elettronico può modificare significativamente la selettività di reazione del catalizzatore.
Nella reazione di ossidazione parziale del metanolo, i catalizzatori d'oro (Au) sono utilizzati per generare formaldeide, ma in presenza di ossigeno (O2) o ossidi (ad esempio, allumina), gli atomi di ossigeno adsorbiti modificano la densità di elettroni sulla superficie dei catalizzatori d'oro, portando a un'ulteriore ossidazione della formaldeide ad acido formico o addirittura ad anidride carbonica, riducendo la selettività della formaldeide.
4.3 Riduzione della durata del catalizzatore
I fenomeni di avvelenamento sono spesso irreversibili, soprattutto quando il tossico reagisce fortemente con il catalizzatore per produrre un composto stabile. Questa disattivazione irreversibile significa che il catalizzatore non può essere riportato alla sua attività dopo un lungo periodo con semplici trattamenti (ad esempio, la rigenerazione), riducendo così in modo significativo la vita utile del catalizzatore.
Inoltre, l'azione dei veleni può portare a cambiamenti nella struttura superficiale del catalizzatore o addirittura causare l'agglomerazione o la sinterizzazione delle particelle di catalizzatore, riducendo ulteriormente la stabilità e la durata del catalizzatore.
4.4 Aumento dei costi di processo
Poiché il fenomeno della tossicità porta a una riduzione dell'attività e della durata del catalizzatore, il processo richiede una sostituzione o rigenerazione più frequente del catalizzatore, con conseguente aumento dei costi di produzione. Inoltre, prima della reazione possono essere necessari complessi pretrattamenti della materia prima, come la desolforazione e la disfosforazione, per ridurre gli effetti della tossicità, con un ulteriore aumento dei costi operativi e degli investimenti in attrezzature.
5 Misure per affrontare l'avvelenamento da catalizzatore
5.1 Modifica del catalizzatore
1. Lega: La lega è la formazione di catalizzatori in lega con proprietà migliorate combinando metalli preziosi con altri metalli. Questo metodo è efficace per migliorare la resistenza del catalizzatore alla tossicità. Ad esempio, il palladio (Pd) viene legato con altri metalli come l'oro (Au) o l'argento (Ag) per migliorare la sua resistenza ai composti di zolfo e azoto.
I solfuri sono uno dei comuni veleni dei catalizzatori, soprattutto nella raffinazione del petrolio e nei processi chimici. Legando il palladio (Pd) con l'oro (Au) o l'argento (Ag), è possibile migliorare notevolmente la resistenza dei catalizzatori ai solfuri. Ad esempio, i catalizzatori in lega palladio-oro offrono una maggiore resistenza all'avvelenamento da solfuri rispetto ai catalizzatori di palladio puro perché la presenza dell'oro altera la struttura elettronica della superficie del catalizzatore e riduce l'adsorbimento dello zolfo, rallentando così il tasso di avvelenamento.
Anche i nitruri sono una delle principali fonti di avvelenamento dei catalizzatori, soprattutto nella sintesi dell'ammoniaca e nelle reazioni di denitrificazione. La lega del palladio con altri metalli, come il rame Cu o il platino Pt, consente di migliorare la tolleranza del catalizzatore ai nitruri. La lega può regolare la densità di elettroni e la geometria della superficie del catalizzatore, ridurre la forza di adsorbimento dei nitruri e ritardare la disattivazione del catalizzatore.
2. Modifica della superficie: Modifica della superficie del catalizzatore, come l'aggiunta di uno strato di ossido o di carbonio alla superficie del catalizzatore di metalli nobili, per evitare che i veleni entrino direttamente in contatto con i siti attivi. Ad esempio, il rivestimento di ossido e la modifica dello strato di carbonio.
L'aggiunta di un rivestimento di ossido, come l'ossido di alluminio (Al2O3) o il biossido di silicio (SiO2), alla superficie di un catalizzatore di metalli preziosi può migliorare la resistenza del catalizzatore alla tossicità. Ad esempio, un rivestimento di allumina sulla superficie di un catalizzatore di palladio può bloccare efficacemente il contatto dei solfuri con i siti attivi sulla superficie del palladio, migliorando così la resistenza ai solfuri del catalizzatore di palladio. Inoltre, il rivestimento di ossido può fornire ulteriori siti acidi o basici, migliorando ulteriormente la selettività e l'attività del catalizzatore.
Anche l'aggiunta di uno strato di carbonio alla superficie di un catalizzatore di metalli preziosi è un metodo efficace di modifica della superficie. Lo strato di carbonio può impedire il contatto diretto di sostanze tossiche con i siti attivi del catalizzatore attraverso l'adsorbimento e la schermatura. Ad esempio, depositando uno strato di grafene o di carbone attivo sulla superficie di un catalizzatore di palladio, è possibile migliorarne la tolleranza ai solfuri e ai nitruri, pur mantenendo una buona attività catalitica. La modifica dello strato di carbonio non solo migliora la resistenza del catalizzatore alla tossicità, ma ne aumenta anche la stabilità termica e la resistenza meccanica.
5.2 Pretrattamento delle materie prime
Il pretrattamento delle materie prime è una fase fondamentale per evitare l'avvelenamento dei catalizzatori di metalli preziosi. Grazie a un efficace trattamento di desolforazione, desfosforazione e denitrogenazione, è possibile ridurre significativamente l'effetto del veleno sul catalizzatore, prolungarne la durata e mantenerne efficienti le prestazioni catalitiche.
1. Desolforazione: Per desolforazione si intende la rimozione dei solfuri dalla materia prima della reazione, per evitare l'avvelenamento del catalizzatore da parte dei solfuri. I solfuri sono uno dei veleni comuni dei catalizzatori, soprattutto nella raffinazione del petrolio e nella produzione chimica, dove reagiscono con i siti attivi sulla superficie del catalizzatore, provocandone la disattivazione. L'idrodesolforazione è una tecnologia di desolforazione comune che rimuove l'idrogeno solforato dalla materia prima facendo reagire il solfuro ad alta temperatura e ad alta pressione con gas idrogenato contenente idrogeno per convertire il solfuro in idrogeno solforato (H₂S). Questo metodo rimuove efficacemente i composti organosolforati come mercaptani, tioeteri e tioesteri dalla materia prima, riducendo così l'effetto tossico di questi solfuri sul catalizzatore.
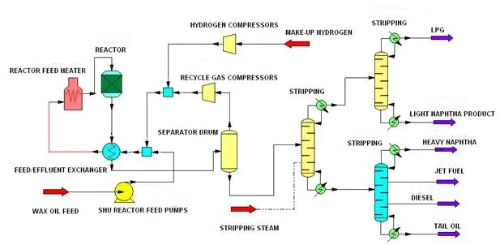
Fig. 9 Processo di idrodesolforazione
2. Defosforilazione: anche il fosfuro è una delle principali fonti di avvelenamento del catalizzatore, soprattutto in alcune reazioni catalitiche, il fosfuro reagisce con la superficie del catalizzatore, portando alla rottura del sito attivo. Pertanto, è molto necessario utilizzare un agente de-fosforilante per de-fosforare la materia prima. L'agente fosforilante è un reagente chimico specificamente progettato per rimuovere il fosfuro dalla materia prima. L'agente fosforilante reagisce con i fosfuri presenti nella materia prima formando un precipitato solido insolubile nella materia prima e quindi li rimuove. Ad esempio, in alcuni processi industriali, gli agenti de-fosforanti a base di calcio possono essere utilizzati per reagire con i fosfati e formare precipitati di fosfato di calcio, raggiungendo così lo scopo della de-fosforilazione.
3. Denitrogenazione: Anche i composti contenenti azoto sono una delle principali cause di avvelenamento dei catalizzatori, soprattutto nelle reazioni petrolchimiche e di sintesi organica, dove i composti azotati si combinano con i siti attivi del catalizzatore, provocandone la disattivazione. Per evitare ciò, è necessaria la denitrificazione della materia prima. I composti contenenti azoto sono anche una delle principali cause di avvelenamento dei catalizzatori, soprattutto nelle reazioni di sintesi petrolchimica e organica, dove i nitruri si combinano con i siti attivi del catalizzatore, provocandone la disattivazione. Per evitare questa situazione, è necessaria la denitrificazione delle materie prime.
5.3 Ottimizzazione delle condizioni di reazione
1. Controllare la temperatura di reazione: la temperatura di reazione ha un'influenza diretta sull'attività e sulla stabilità del catalizzatore. Il comportamento di adsorbimento e desorbimento dei reagenti e degli intermedi, così come il tasso di generazione dei veleni, cambiano in condizioni di temperatura diverse. Ottimizzando la temperatura di reazione, è possibile ridurre la generazione e l'adsorbimento di sostanze tossiche. L'esecuzione della reazione a temperature più basse riduce la generazione di alcuni sottoprodotti tossici. Molti tossici (ad esempio, solfuri e fosfuri) si formano più facilmente a temperature più elevate e la riduzione della temperatura di reazione può inibire la formazione di questi sottoprodotti. Ad esempio, nel processo di idrodesolforazione (HDS), la produzione di idrogeno solforato (H₂S) può essere ridotta abbassando la temperatura di reazione, proteggendo il catalizzatore dall'avvelenamento da solfuro. Le basse temperature contribuiscono a ridurre l'adsorbimento dei veleni sulla superficie del catalizzatore. Le alte temperature aumentano l'energia cinetica dei reagenti e dei veleni, rendendo più facile il loro forte chemisorbimento con i siti attivi sulla superficie del catalizzatore, che può portare all'avvelenamento del catalizzatore. Controllando la temperatura di reazione, è possibile ridurre l'adsorbimento dei veleni e prolungare il ciclo attivo del catalizzatore.
2. Controllo della pressione dell'idrogeno: nella reazione di idrogenazione, la pressione dell'idrogeno è un parametro chiave, che influenza direttamente la velocità di reazione e la selettività del catalizzatore. Ottimizzando la pressione dell'idrogeno, è possibile ridurre efficacemente l'idrogenazione eccessiva e la formazione di veleni, proteggendo così il catalizzatore di metalli preziosi dall'avvelenamento. Nelle reazioni di idrogenazione, una pressione di idrogeno troppo elevata può portare a un'idrogenazione eccessiva dei reagenti e alla generazione di prodotti completamente idrogenati indesiderati. Ad esempio, in una reazione di idrogenazione parziale di alchini, una pressione di idrogeno troppo elevata può portare a un'idrogenazione eccessiva degli alchini in alcani invece che in olefine. Controllando la pressione dell'idrogeno, è possibile regolare con precisione il grado di idrogenazione dei reagenti per evitare la sovra-idrogenazione, migliorando così la selettività della reazione e proteggendo l'attività del catalizzatore. La pressione dell'idrogeno influisce anche sulla generazione di veleni. In alcune reazioni, un'eccessiva pressione dell'idrogeno può favorire il verificarsi di reazioni collaterali e la generazione di sottoprodotti tossici. Ad esempio, nell'ossidazione parziale del metano, una pressione di idrogeno eccessiva può portare a un'ulteriore ossidazione della formaldeide ad acido formico o anidride carbonica, aumentando così la tossicità dei veleni per il catalizzatore. Ottimizzando la pressione dell'idrogeno, è possibile inibire il verificarsi di queste reazioni collaterali, ridurre la formazione di veleni e proteggere l'attività del catalizzatore.
5.4 Rigenerazione del catalizzatore
La rigenerazione dei catalizzatori è una parte importante del processo per evitare l'avvelenamento dei catalizzatori di metalli preziosi. Nel corso dell'utilizzo, i catalizzatori vengono inevitabilmente contaminati da veleni, che portano a una diminuzione dell'attività catalitica. Attraverso opportune tecniche di rigenerazione, i veleni presenti sulla superficie del catalizzatore possono essere rimossi e le sue prestazioni catalitiche possono essere ripristinate.

Fig. 10 Confronto dell'aspetto di vari catalizzatori prima e dopo la rigenerazione
1. Rigenerazione chimica: Rimozione dei veleni sulla superficie del catalizzatore con metodi chimici, come il trattamento di ossidazione o riduzione. Questo metodo comprende un trattamento ossidante e un trattamento riducente.
Il trattamento di ossidazione rimuove i veleni sulla superficie del catalizzatore introducendo ossigeno o altri agenti ossidanti per ossidare e decomporre i veleni organici o altre sostanze ossidabili sulla superficie del catalizzatore. Ad esempio, per un catalizzatore contaminato da idrocarburi, è possibile introdurre aria o ossigeno ad alta temperatura per ossidare gli idrocarburi sulla superficie in anidride carbonica e acqua, eliminando così i veleni.
I trattamenti di riduzione vengono eseguiti sui catalizzatori contaminati da veleni riducenti introducendo un agente riducente, come l'idrogeno, per ripristinare la loro attività. Ad esempio, un catalizzatore di palladio avvelenato da solfuro può essere sottoposto a un trattamento di riduzione in atmosfera di idrogeno per convertire il solfuro di palladio sulla superficie in palladio metallico e idrogeno solforato gassoso, eliminando così il veleno e ripristinando l'attività del catalizzatore.
2. Trattamento termico di rigenerazione: Rimuovere i veleni organici o i depositi di coke sulla superficie del catalizzatore mediante arrostimento ad alta temperatura per ripristinare l'attività del catalizzatore. Questo metodo comprende l'arrostimento e il trattamento di pirolisi.
L'arrostimento ad alta temperatura consiste nel trattare il catalizzatore ad alte temperature per rimuovere i veleni organici o i depositi di carbonio sulla superficie mediante decomposizione termica o combustione. Ad esempio, per un catalizzatore avvelenato da depositi di coke, il catalizzatore può essere trattato mediante arrostimento ad alta temperatura per bruciare il coke sulla superficie, eliminando così i veleni e ripristinando l'attività del catalizzatore. La temperatura e il tempo di arrostimento devono essere ottimizzati in base alla natura del catalizzatore e al tipo di veleno, per garantire un'efficace rimozione del veleno senza danneggiare la struttura del catalizzatore.
Il trattamento di pirolisi rimuove i veleni decomponendo i veleni organici sulla superficie del catalizzatore in prodotti volatili ad alta temperatura. Ad esempio, per i catalizzatori avvelenati da organofosfati, il trattamento di pirolisi può essere eseguito ad alte temperature per decomporre i fosfuri in prodotti gassosi, eliminando così i veleni e ripristinando l'attività del catalizzatore.
5.5 Uso di inibitori selettivi di tossicità
Anche l'aggiunta di co-catalizzatori al sistema di reazione può essere efficace per proteggere i catalizzatori di metalli preziosi. Ad esempio, l'aggiunta di piccole quantità di ossidi metallici può adsorbire o convertire le sostanze tossiche, proteggendo così l'attività del catalizzatore. Nei sistemi catalitici di palladio, l'aggiunta di piccole quantità di ossidi di lantanio (La) o cerio (Ce) può migliorare significativamente la resistenza allo zolfo del catalizzatore. Questi ossidi metallici reagiscono con le sostanze tossiche e impediscono loro di legarsi al catalizzatore di metallo prezioso, prolungando così la vita del catalizzatore e mantenendone l'efficienza.
5.6 Progetti di catalizzatori avanzati
1. Catalizzatori core-shell: I catalizzatori core-shell sono un progetto di catalizzatore in cui il nucleo metallico attivo è incapsulato in uno strato stabile di guscio. Un catalizzatore core-shell è costituito da un nucleo (metallo attivo) e da un guscio (strato protettivo). Il guscio è solitamente costituito da un materiale stabile con una buona resistenza alla tossicità, come ossidi di silice mesoporosa, materiali di carbonio o allumina. Il materiale del guscio consente ai reagenti di raggiungere i siti attivi del nucleo progettando pori e canali di dimensioni adeguate e bloccando l'ingresso di veleni macromolecolari. Questo design strutturale consente al nucleo metallico attivo di passare solo attraverso micropori o nanocanali quando entra in contatto con i reagenti, impedendo così efficacemente ai veleni di entrare in contatto diretto e di adsorbirsi sulla superficie del metallo attivo. Nel caso del palladio (Pd), ad esempio, i catalizzatori in cui il nucleo di palladio è incapsulato da ossidi di silicio mesoporosi (SiO2) possono essere significativamente più resistenti alla tossicità. In questa struttura, il nucleo di palladio fornisce un'efficiente attività catalitica, mentre lo strato mesoporosodiSiO2, grazie alla selettività delle dimensioni dei pori, consente ai reagenti di piccole molecole di entrare e reagire con il nucleo di palladio, bloccando al contempo i veleni di grandi molecole, prevenendo così efficacemente l'avvelenamento del nucleo di palladio.
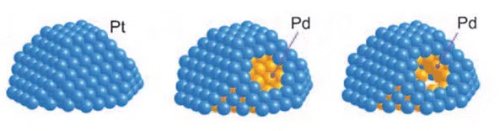
Fig. 11 La struttura del catalizzatore a guscio centrale Pt-Pd
2. Catalizzatori monoatomici: I catalizzatori monoatomici sono realizzati disperdendo fortemente gli atomi di metallo attivo sulla superficie del supporto in modo che ogni sito attivo sia costituito da un singolo atomo. Questa struttura altamente dispersiva massimizza l'uso degli atomi di metallo e aumenta significativamente l'attività e la selettività del catalizzatore. Allo stesso tempo, poiché ogni atomo di metallo è indipendente, è difficile che i veleni si aggreghino sulla sua superficie, riducendo così il rischio di avvelenamento del catalizzatore. Ad esempio, i catalizzatori di palladio a singolo atomo possono essere altamente dispersi su supporti di carbonio drogati con azoto. Ogni atomo di palladio è stabilizzato sui siti drogati di azoto grazie a forti interazioni e questo design non solo aumenta l'attività catalitica, ma migliora anche significativamente la resistenza del catalizzatore ai veleni. Poiché è difficile che i veleni si aggreghino attorno ai singoli atomi di palladio, il catalizzatore è molto più resistente alla tossicità.
5.7 Processi catalitici ecologici
Per ridurre il problema della tossicità dei catalizzatori convenzionali si possono adottare le seguenti misure specifiche. In primo luogo, utilizzare solventi ecologici, come quelli verdi, come l'acqua olaCO₂supercritica, al posto dei solventi organici tossici, per ridurre l'effetto di avvelenamento dei veleni sul catalizzatore. Questo non solo contribuisce a migliorare la sicurezza della reazione, ma riduce anche l'inquinamento ambientale. In secondo luogo, vengono sviluppati nuovi sistemi catalitici, come la ricerca e lo sviluppo di tecnologie emergenti come la catalisi enzimatica o la fotocatalisi. La catalisi enzimatica realizza reazioni chimiche verdi grazie all'elevata selettività ed efficienza degli enzimi biologici, mentre la fotocatalisi utilizza l'energia luminosa per guidare il processo di reazione ed evita il problema dell'avvelenamento dei catalizzatori tradizionali. Questi approcci innovativi non solo migliorano l'efficienza della reazione, ma riducono anche l'impatto negativo sull'ambiente e sulla salute.
6 Conclusioni
I catalizzatori di metalli preziosi hanno un ruolo insostituibile nell'industria chimica, nella conversione energetica e nella protezione dell'ambiente grazie alle loro efficienti prestazioni catalitiche e all'ampia gamma di applicazioni. Tuttavia, la tossicità dei catalizzatori ne limita fortemente il funzionamento stabile a lungo termine e gli effetti applicativi. Attraverso uno studio approfondito del meccanismo dei catalizzatori di metalli preziosi e delle cause del fenomeno dell'avvelenamento, possiamo adottare diverse misure per migliorare la capacità anti-avvelenamento e la durata dei catalizzatori.
In primo luogo, la modifica dei catalizzatori, come la legatura e la modifica della superficie, può migliorare significativamente le prestazioni anti-avvelenamento dei catalizzatori. In secondo luogo, il pretrattamento della materia prima e l'ottimizzazione delle condizioni di reazione possono ridurre efficacemente la generazione e l'adsorbimento di sostanze tossiche. Inoltre, la rigenerazione del catalizzatore e l'uso di inibitori selettivi dei tossici possono contribuire a ripristinare e mantenere l'attività del catalizzatore. I design avanzati dei catalizzatori, come i catalizzatori strutturati a guscio di nucleo e i catalizzatori a singolo atomo, forniscono nuove vie per l'anti-avvelenamento. Infine, l'applicazione di processi catalitici verdi non solo contribuisce alla riduzione dei problemi di tossicità, ma promuove anche il processo di sviluppo sostenibile.
In conclusione, le prestazioni e la durata dei catalizzatori di metalli preziosi possono essere significativamente migliorate dall'applicazione combinata di queste strategie, soddisfacendo così la domanda di catalizzatori efficienti, stabili e rispettosi dell'ambiente nella produzione industriale. La ricerca futura dovrebbe continuare a dedicarsi allo sviluppo di nuovi catalizzatori anti-avvelenamento e di tecnologie catalitiche verdi per promuovere ulteriormente l'ampia applicazione dei catalizzatori di metalli preziosi in vari campi.
Lettura correlata:
Applicazioni dei catalizzatori di metalli preziosi: Approfondimenti su polvere e pellet
Riferimenti:
[1] Qin T, Li N, Ma H, et al. Effetti dei metalli del gruppo VIII sulla pirolisi della lignite e sulla gassificazione del carbone con un catalizzatore a base di Ca[J]. Carburante,2024,372.
[2] Lysne A, Saxrud I, Snidaro L R, et al. Catalizzatori di metalli nobili (Pt, Pd e Rh) promossi da Ni-Co/Mg (Al)O per lo steam reforming di impurità di catrame dalla gassificazione di biomasse[J]. Journal of Catalysis, 2024, 436.
[3] Nejadmoghadam E, Achour A, Öhrman O, et al. Stabilizzazione di olio di pirolisi simulato fresco e invecchiato attraverso un blando idrotrattamento con catalizzatori di metalli nobili[J]. Energy Conversion and Management, 2024,313.
[4] Li L, Chen T, Zhang L, et al. Recenti progressi dei nanomateriali a base di Ni come promotori per migliorare le prestazioni della reazione di evoluzione dell'idrogeno dei catalizzatori di metalli nobili[J]. Journal of Alloys and Compounds, 2024,998.
[Yun W, Rui Y, Qiang Z, et al. Nanocristalli di La-RuO2 con un'efficiente attività elettrocatalitica per la scissione globale dell'acqua in ambiente acido: Effetto sinergico del drogaggio del La e della vacanza di ossigeno[J]. Chemical Engineering Journal, 2022, 439.

 Bar
Bar
 Perline e sfere
Perline e sfere
 Bulloni e dadi
Bulloni e dadi
 Crogioli
Crogioli
 Dischi
Dischi
 Fibre e tessuti
Fibre e tessuti
 Film
Film
 Fiocco
Fiocco
 Schiume
Schiume
 Lamina
Lamina
 Granuli
Granuli
 Nidi d'ape
Nidi d'ape
 Inchiostro
Inchiostro
 Laminato
Laminato
 Grumi
Grumi
 Maglie
Maglie
 Film metallizzato
Film metallizzato
 Piatto
Piatto
 Polveri
Polveri
 Asta
Asta
 Lenzuola
Lenzuola
 Cristalli singoli
Cristalli singoli
 Bersaglio di sputtering
Bersaglio di sputtering
 Tubi
Tubi
 Lavatrice
Lavatrice
 Fili
Fili
 Convertitori e calcolatori
Convertitori e calcolatori
 Scrivi per noi
Scrivi per noi
 Chin Trento
Chin Trento



