Tutto quello che dovreste sapere sulle nanoparticelle MoO3
Introduzione
Il triossido di molibdeno è uno degli ossidi di metalli di transizione con formula chimica MoO3(H2O)n (n=0-3). Il MoO3 è utilizzato in un'ampia gamma di applicazioni, quali fotocatalizzatori, ottica, rilevamento dei gas, batterie, dispositivi elettronici e così via. Il MoO3 anidro presenta una struttura ottaedrica distorta "MoO6". La Figura 1 ne rappresenta il cristallo ortorombico. Le sfere verdi sono di molibdeno e quelle rosse di ossigeno. Il MoO3 ha 3 diverse strutture cristalline: le fasi α-ortobica, β-monoclina e h-esagonale. Le diverse strutture di MoO3 conferiscono loro diverse proprietà fisiche e chimiche. L'h-MoO3 mostra stabilità di fase fino a 436℃, ma l'α-MoO3 mostra una transizione di fase irreversibile sotto i 436℃ [1].

Figura 1: Struttura degli ottaedri di MoO6
Come viene realizzata la nanostruttura di MoO3 e discussione sulla sintesi per combustione in soluzione
Esistono diversi metodi sintetici per preparare le nanoparticelle di triossido di molibdeno:
Sintesi idrotermale: i sali di molibdeno, come il molibdato di ammonio, reagiscono con il perossido di idrogeno in una soluzione acquosa ad alta temperatura e pressione per formare nanoparticelle di MoO3.
Sintesi solvotermica: i sali di molibdeno reagiscono con un solvente organico come l'etanolo in un ambiente ad alta temperatura per formare nanoparticelle di MoO3.
Co-precipitazione: una soluzione di sali di molibdeno reagisce con un agente di precipitazione, come un idrossido o un carbonato di metallo a un determinato pH e le nanoparticelle di MoO3 precipitano dalla soluzione.
Sintesi per combustione in soluzione: i sali di molibdeno si mescolano con una miscela di combustibile e ossidante e bruciano ad alta temperatura per formare nanoparticelle di MoO3.
Esistono molte altre vie di sintesi che non sono state menzionate in questa sede. Per ulteriori informazioni o interessi, contattateci alla Stanford Advanced Materials. Anche in una stessa sintesi, parametri diversi porteranno a diversi tipi di strutture di nano MoO3. Utilizziamo la sintesi per combustione in soluzione come esempio.
Sciogliere l'eptamolibdato di ammonio (NH4)6Mo7O24-4H2O in acqua distillata e mescolare la soluzione con un solvente organico (qui usiamo Urea, EDTA, PEG 200 e Sorbitolo come diversi additivi organici per fare gli esperimenti). Riscaldare e agitare la soluzione fino alla formazione dei precipitati. L'ultima fase consiste nel riscaldare i precipitati per eliminare gli additivi organici e altre impurità [2].
L'eptamolibdato di ammonio (AHM) è una molecola complessa di grandi dimensioni che viene spesso utilizzata come precursore nella produzione di composti di Mo. L'equazione chimica di sintesi della combustione in soluzione dell'AHM è la seguente
Il MoO3 può formarsi senza l'uso di additivi, ma gli additivi svolgono un ruolo importante nel guidare la crescita dei cristalli e dei nuclei di MoO3. Utilizziamo un microscopio elettronico a scansione (SEM) per rilevare le microstrutture prodotte dall'uso di diversi additivi organici. Si ottengono le seguenti osservazioni: L'urea produce una morfologia più sferica rispetto agli altri 3 additivi. Il PEG 200 produce nanoparticelle più grandi e meno sferiche. Il sorbitolo e l'EDTA producono nanorods molto diversi tra loro [2]. Queste differenze sono dovute alla struttura chimica degli additivi organici. La Figura 2 qui sotto illustra le strutture chimiche di questi quattro additivi organici. L'urea ha un azoto con una coppia di elettroni non vincolanti. Il PEG200 e il sorbitolo hanno ossigeno nel gruppo OH. L'EDTA ha entrambi gli azoto con una coppia di elettroni non leganti e l'ossigeno nel gruppo OH. Nella formazione del ligando, l'azoto con 2 elettroni liberi è più dell'ossigeno. Pertanto, l'urea attrae più facilmente il Mo dall'AHM per formare nuclei di dimensioni minori rispetto al PEG200 e al sorbitolo [2].
L'EDTA ha 2 azoto con 2 elettroni liberi e 4 ossigeno in OH. A prima vista, potrebbe essere l'additivo più adatto per la produzione di nanoparticelle di MoO3. Ma l'EDTA è un composto complesso molto grande, come già detto. L'effetto di ostacolo sterico impedisce all'azoto dell'EDTA di attrarre il Mo. Solo il gruppo ossigeno è coinvolto nella struttura del ligando e crea le microstrutture di MoO3 [2].
Il PEG200 ha solo un gruppo ossigeno sui due lati. Non è attrattivo come l'urea, il che significa che ha una bassa possibilità di formare MoO3 simultaneamente su entrambi i lati. Ma il PEG200 è un composto dalla struttura molto semplice, con un basso effetto di ostacolo sterico. È più facile per il PEG 200 formare il ligando che per l'EDTA [2].
Quando uno dei gruppi ossigeno del sorbitolo si lega al Mo, è impossibile che l'altro gruppo ossigeno si leghi ad altri Mo a causa della sua struttura lineare. In definitiva, il sorbitolo non è un buon additivo per la produzione di nanoparticelle di MoO3 [2]. Anche altre condizioni come il pH, la temperatura di reazione, la concentrazione di Mo e il rapporto Mo/additivo possono influenzare le proprietà delle nanoparticelle di MoO3 prodotte.
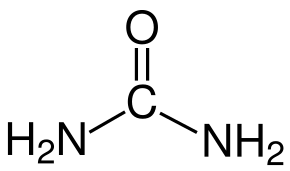
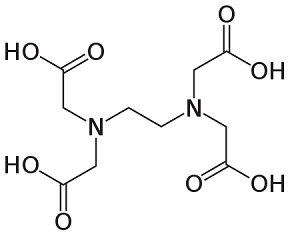
Urea EDTA
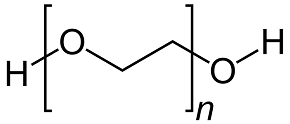
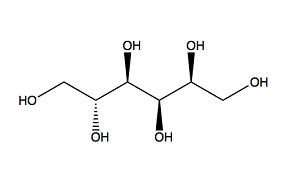
PEG200 Sorbitolo
Figura 2: strutture molecolari degli additivi organici utilizzati nell'esperimento
Applicazioni del MoO3
La membrana MoO3 ha buone proprietà elettrocromiche. Rispetto ad altri materiali come WO3 e TiO2, il MoO3 ha un tempo di risposta più breve. Inoltre, il MoO3 diventa grigio quando rileva uno stimolo elettrico. La sua curva di assorbimento è regolare nella regione del visibile. Il picco di assorbimento è vicino a 550 nm, che è vicino alla banda sensibile dell'occhio umano. Come produrre MoO3 supremo mediante nanoparticelle di MoO3 è una delle ricerche più popolari.
Il PVC è un materiale polimerico termoplastico ampiamente utilizzato, ma produce un fumo denso quando brucia. Il metallo di transizione mostra una buona soppressione del fumo. Combinando 2 o più tipi di composti di metalli di transizione, il fumo denso del PVC può essere seriamente limitato. Il PVC presenta gravi rischi di incendio a causa dell'aggiunta di plastificanti. Il MoO3 mostra anche un buon ritardo di fiamma. Combinando il MoO3 con il Cu2O, si ottiene un effetto sinergico che può ridurre il costo dell'additivo MoO3 puro e mantenere le buone proprietà dei cavi.
Il MoO3 è un fotocatalizzatore altamente efficiente. A differenza del tradizionale trattamento dei coloranti delle acque reflue, i nanocatalizzatori possono convertire gli inquinanti in prodotti innocui come la CO2 [3]. Le nanoparticelle conferiscono al MoO3 un'area di contatto maggiore per accelerare il tasso di degradazione.
Il MoO3 è un semiconduttore di tipo n che può essere utilizzato in vaste applicazioni come il rilevamento di gas. I rilevatori di gas a ossidi metallici "trasferiscono" il gas in elettricità, in modo più rapido e semplice rispetto ad altri rilevatori. A differenza di altri rivelatori di gas a ossidi metallici, il MoO3 è un materiale semiconduttore ad ampio band-gap con siti attivi sulla sua superficie che reagiscono selettivamente con il gas da misurare. Il MoO3 presenta elevate caratteristiche di sensibilità ai gas. Mostra sensibilità a NH3, H2, CO e altri gas a circa 450℃. La membrana MoO3 pura non funziona bene a causa della sua temperatura e selettività altamente sensibili. La combinazione con altri materiali migliora la capacità di MoO3 di essere sensibile ai gas. Ad esempio, combinando MoO3 con V2O5 si ottengono membrane altamente sensibili a basse temperature (circa 150℃) a NO2, NH3, CO, CH4, SO2 e H2.
Ci sono molte applicazioni per le nanoparticelle di MoO3 che non sono state menzionate. Stanford Advanced Materials (SAM) fornisce diversi tipi di MoO3. Se desiderate maggiori informazioni sul MoO3, potete fornire le vostre informazioni sulle applicazioni al nostro personale tecnico per una consulenza.
Riferimento
- Pannipa Wongkrua, Titipun Thongtem, Somchai Thongtem, "Sintesi di h- e α-MoO3 mediante combinazione di riflusso e calcinazione: trasformazione di fase e morfologia, fotocatalisi e fotosensibilizzazione", Journal of Nanomaterials, vol. 2013, Article ID 702679, 8 pagine, 2013. https://doi.org/10.1155/2013/702679
- Parviz, D., Kaz→emeini, M., Rashidi, A. M., & Jafari Jozani, K. (2009). Sintesi e caratterizzazione di nanostrutture di MOO3 con il metodo della combustione in soluzione, utilizzando il controllo della morfologia e delle dimensioni. Journal of Nanoparticle Research, 12(4), 1509-1521. https://doi.org/10.1007/s11051-009-9727-6
- Thekkethil, A. J., Sreekuttan, S., & Madhavan, A. A. (2021). Applicazione del nano triossido di molibdeno nell'accumulo termico e nella fotocatalisi. Journal of Physics: Conference Series, 2070(1), 012120. https://doi.org/10.1088/1742-6596/2070/1/012120

 Bar
Bar
 Perline e sfere
Perline e sfere
 Bulloni e dadi
Bulloni e dadi
 Crogioli
Crogioli
 Dischi
Dischi
 Fibre e tessuti
Fibre e tessuti
 Film
Film
 Fiocco
Fiocco
 Schiume
Schiume
 Lamina
Lamina
 Granuli
Granuli
 Nidi d'ape
Nidi d'ape
 Inchiostro
Inchiostro
 Laminato
Laminato
 Grumi
Grumi
 Maglie
Maglie
 Film metallizzato
Film metallizzato
 Piatto
Piatto
 Polveri
Polveri
 Asta
Asta
 Lenzuola
Lenzuola
 Cristalli singoli
Cristalli singoli
 Bersaglio di sputtering
Bersaglio di sputtering
 Tubi
Tubi
 Lavatrice
Lavatrice
 Fili
Fili
 Convertitori e calcolatori
Convertitori e calcolatori
 Chin Trento
Chin Trento



