Diagrammi di fase: Tipi ed esempi
Introduzione ai diagrammi di fase
Idiagrammi di fase sono strumenti essenziali nella chimica e nella scienza dei materiali e forniscono una rappresentazione grafica degli stati fisici di una sostanza in diverse condizioni di temperatura e pressione. Questi diagrammi aiutano gli scienziati e gli ingegneri a prevedere il comportamento dei materiali durante processi come il riscaldamento, il raffreddamento e la compressione.
Gli stati della materia
La comprensione dei tre statiprimari della materia - solido, liquido e gas - è fondamentale per interpretare i diagrammi di fase.
Lo stato solido
Nello stato solido, le molecole sono strettamente impacchettate in una struttura fissa, che dà luogo a una forma e a un volume definiti. I solidi hanno un'alta densità e una bassa entropia rispetto ai liquidi e ai gas.
Liquido
I liquidi hanno un volume definito ma assumono la forma del loro contenitore. Le molecole di un liquido sono meno strette rispetto a quelle di un solido, il che consente una maggiore fluidità e un'entropia più elevata.
Gas
I gas non hanno né una forma né un volume definiti. Le molecole sono molto distanziate e si muovono liberamente, il che porta all'entropia più alta tra i tre stati.
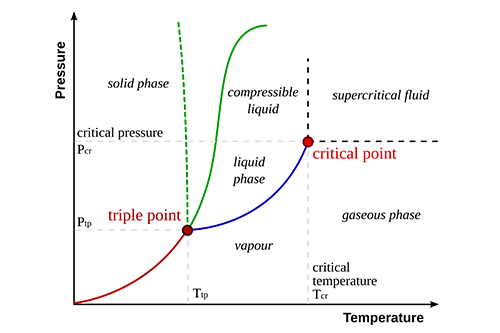
Caratteristiche principali dei diagrammi di fase
I diagrammi di fase includono in genere diverse caratteristiche chiave:
- Punto triplo: L'insieme unico di condizioni in cui le fasi solida, liquida e gassosa coesistono in equilibrio.
- Punto critico: La temperatura e la pressione oltre le quali un gas non può essere liquefatto.
- Confini di fase: Linee che separano fasi diverse, indicando le condizioni in cui una fase si trasforma in un'altra.
Importanza dei diagrammi di fase
I diagrammi di fase sono fondamentali in diverse applicazioni, tra cui:
- Scienza dei materiali: Progettazione di materiali con proprietà specifiche controllando la loro fase durante la lavorazione.
- Meteorologia:comprensione delle condizioni atmosferiche e dei modelli meteorologici.
- Ingegneria chimica: Ottimizzare le reazioni e le separazioni controllando la temperatura e la pressione.
Tabella dei diagrammi di fase
|
Regione di fase |
Caratteristiche |
Esempio di condizioni |
|
Solido |
Forma e volume fissi, bassa entropia |
Ghiaccio a 0°C e 1 atm |
|
Liquido |
Volume definito, la forma si adatta al contenitore |
Acqua a 25°C e 1 atm |
|
Gas |
Nessuna forma o volume fisso, elevata entropia |
Vapore acqueo a 100°C e 1 atm |
|
Punto triplo |
Tutte e tre le fasi coesistono |
0,01°C e 0,006 atm per l'acqua |
|
Punto critico |
Oltre questo punto, le fasi liquida e gassosa sono indistinguibili |
374°C e 218 atm per l'acqua |
Per ulteriori informazioni, consultareStanford Advanced Materials (SAM).
Domande frequenti
Quali informazioni posso ottenere da un diagramma di fase?
Un diagramma di fase mostra la stabilità di diverse fasi (solide, liquide, gassose) a varie temperature e pressioni, aiutando a prevedere il comportamento del materiale.
Che significato ha il punto triplo nei diagrammi di fase?
Il punto triplo è il punto in cui le fasi solide, liquide e gassose coesistono in equilibrio, fornendo condizioni uniche per lo studio delle transizioni di fase.
Cosa succede nel punto critico di un diagramma di fase?
Nel punto critico, la distinzione tra fase liquida e fase gassosa scompare, dando origine a un fluido supercritico con proprietà uniche.
I diagrammi di fase possono essere utilizzati per le miscele o solo per le sostanze pure?
I diagrammi di fase possono essere costruiti sia per le sostanze pure che per le miscele, anche se i diagrammi per le miscele sono più complessi a causa delle variabili aggiuntive.
Come sono utili i diagrammi di fase nelle applicazioni industriali?
Aiutano a progettare processi come la cristallizzazione, la distillazione e la sintesi di materiali, prevedendo i cambiamenti di fase in diverse condizioni.